Le lait et sa coagulation
Auteur: Florian Ronez, thèse de doctorat, 2012.
Les procédés industriels agro-alimentaires intègrent bien souvent des contraintes d’ordre physique générant un impact qui peut altérer la structure et donc la fonction de certains ingrédients (Wang, 1999). Parmi ces ingrédients, les protéines interviennent quasiment systématiquement dans l’élaboration de produits alimentaires. Il apparaît alors nécessaire pour un industriel d’être capable de stabiliser la structure de protéines d’intérêt dans le produit final, afin de lui garantir ses qualités et de maitriser les processus se produisant à l’interface eau/lipides lieu de l’interaction entre les protéines et les lipides. C’est notamment le cas lors de la fabrication de produits laitiers. Les modifications de la température, du pH ou de la force ionique, permettent le processus de gélification mais contrôlent aussi la cinétique de formation du réseau et par conséquent la structuration du gel de caséine. Les traitements physiques excessifs sont connus pour altérer la qualité du gel laitier (texture, viscosité, stabilité dans le temps) en générant des phénomènes de dénaturation qui perturbent la formation du réseau de macromolécules (Ikeda & Nishinari, 2001).
La protéine Lo18, de par ses activités de chaperon moléculaire et de lipochaperon, pourrait être mise en œuvre afin d’influencer la mise en place des matrices fromagères en modulant les phénomènes d’interaction entre les protéines et les lipides.
1. Généralités sur le lait
La composition du lait est caractérisée par une grande complexité dans la nature et la forme de ses composants. Quatre composants sont dominants (Jenness, 1988) du point de vue quantitatif dans le lait de vache :
- l’eau (90%)
- les matières grasses (3%)
- les protéines solubles et insolubles (3%)
- le lactose (4%)
La consommation de lait après la petite enfance n’est pas nécessaire à la survie, et la capacité de digérer le lactose constitue en fait une adaptation génétique des populations consommant du lait. Cette adaptation est bien présente chez les occidentaux alors quelles est plus rare chez les populations orientales qui peuvent être intolérantes au lactose. Au contraire le fromage ne conduit à aucune intolérance au lactose, car ce dernier y est presque absent. Le fromage constitue un mode de conservation et de consommation important du lait.
2. Les protéines du lait
Le lait de vache est le plus consommé. Les protéines sont présentes à une concentration d’environ 33 g/L et sont réparties en deux grandes classes, les protéines insolubles et les protéines solubles.
a. Les protéines insolubles
i. Caractéristiques générales des protéines insolubles
Il s’agit des caséines qui représentent environ 77 % des protéines totales du lait de vache. Les caséines sont les éléments nobles du lait. Chez les mammifères, elles permettent la transmission des nutriments, et particulièrement de minéraux de la mère à sa progéniture. Les caséines sont des protéines phosphorylées et naturellement riches en minéraux. De plus elles sont principalement associées au phosphate de calcium qui est indispensable pour le développement des os. Les concentrations en calcium dans le lait sont si importantes que sans la présence des caséines celui-ci précipiterait (McMahon & Brown, 1984).
Les caséines constituent également les éléments nobles dans la transformation fromagère car elles représentent le composant fixant le rendement fromager. Les caséines présentent également des propriétés technologiques intéressantes : propriétés émulsifiantes, moussantes, visqueuses, d’hydratation et de gélification (Jenness, 1988).
Les caséines sont des protéines particulières car contrairement à la majorité des protéines cellulaires elles n’adoptent pas de structure tridimensionnelle globulaire bien définie après leur production (Arai & Kuwajima, 2000).
ii. Organisation micellaire
Dans le lait les caséines forment des agrégats hétérogènes solubles composés de polymères des différentes fractions caséiniques associés. On retrouve les caséines sensibles au calcium telles les caséines αS1, αS2 et β qui sont phosphorylées, principalement par des estérifications au niveau des sérines et qui précipitent facilement en présence de calcium. On trouve également les caséines κ qui sont insensibles au calcium, et possèdent des régions hydrophiles. En particulier le caséinomacropeptide, permet de stabiliser toutes les caséines en solution sous formes de complexes stables appelés micelles (Walstra & Jenness, 1984).
Ces micelles sont donc des assemblages hétérogènes de caséines. Leur formation a lieu grâce aux interactions hydrophobes entre les caséines αS1, αS2, β et κ et en fonction de leur taille. Il faut bien noter qu’il s’agit d’une agrégation de protéines conduisant à des assemblages tous différents les uns des autres et non à une oligomérisation ordonnée de sous unités. Il y a dans un premier temps formation de sous micelles contenant une vingtaine de caséines. Ces sous-micelles vont ensuite subir un niveau d’agrégation supérieur ou elles vont s’associer entre elles. Les sous micelles contenant peu ou pas de caséine κ sont les plus hydrophobes, elles s’agrègent facilement et rapidement entre elles et se retrouvent au centre de la micelle. Les sous micelles plus riches en caséine κ sont plus hydrophiles et se positionnent sur le pourtour de la micelle en contact avec le lactosérum (Holt, 1998) La micelle reste alors associée grâce aux forces électrostatiques du milieu s’appliquant sur les caséines κ qui constitue l’enveloppe extérieure, qui limite la taille et empêche précipitation des micelles (Waugh & von Hippel, 1956; Horne, 2006).
Au sein de ce système micellaire complexe il semblerait que le phosphate de calcium joue un rôle de liant entre les caséines sensibles au calcium au sein des sous micelles et micelles.
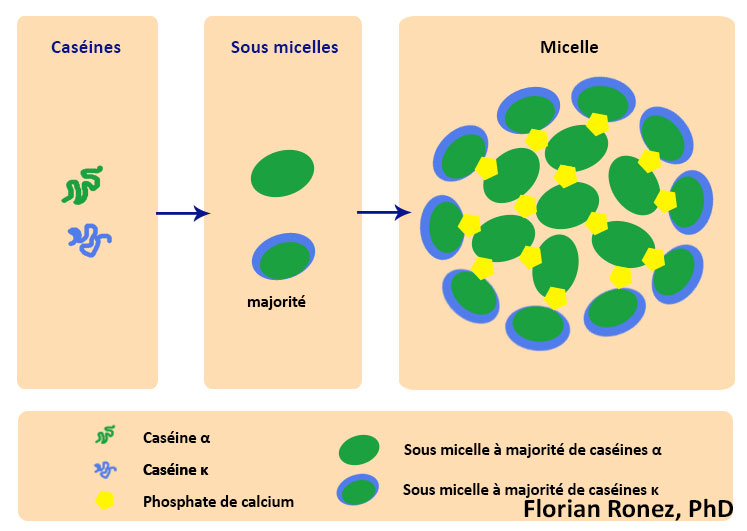
Représentation schématique du processus de formation d’une micelle hétérogène de caséine (d’après de modèle de Schmidt & Walstra).
En effet dès lors que l’on séquestre le calcium avec de l’EDTA (Griffin et al., 1988) ou qu’on l’élimine par dialyse contre un autre tampon ionique (Holt et al., 1986), les micelles perdent leur intégrité. C’est la micelle qui permet la stabilisation et le stockage du phosphate de calcium sous la forme de micro cristaux associés à la caséine αS1. La forme des micelles est subsphérique : leur diamètre moyen varie entre 30 et 300 μm et donne sa couleur blanche au lait (Okigbo et al., 1985).
Le résultat des interactions et répulsions hydrophobes et ioniques au sein des caséines font qu’elles sont relativement stables en conditions natives dans le lait. Mais les micelles peuvent être déstabilisées par voie acide ou enzymatique entraînant ainsi la coagulation du lait.
i. Activité « chaperon like » des caséines
De plus comme les sHsp, (Reddy et al., 2006) les caséines sont de nature hydrophobes, et ne possèdent pas de ponts disulfures ce qui leur confère une grande flexibilité (Zhang et al., 2005b). Plus étonnant il semblerait que tout comme les sHsp les caséines possèdent une activité stabilisante sur d’autres protéines comparable à l’activité de chaperon moléculaire.
Des auteurs (Bhattacharyya & Das, 1999) ont en effet montré que l’αS-caséine peut protéger l’alcool déshydrogénase, l’anhydrase carbonique, et la citrate synthase, contre l’agrégation thermique jusqu’à 60°C. Mais aussi protéger l’insuline contre l’agrégation chimique par le DTT in vitro. Les mêmes auteurs ont enfin montré que l’αS-caséine permet de protéger les protéines du lactosérum contre l’agrégation thermique, suggérant ainsi une action des αS-caséines sur la stabilisation des protéines sériques dans le lait.
D’autres travaux (Zhang et al., 2005b) ont démontré que les β-caséines ont une activité de chaperon moléculaire encore plus importante que les αS-caséines contre l’agrégation de l’insuline, du lysozyme, de la catalase et de l’alcool déshydrogénase. Ces caséines coagrégeraient avec leurs substrats formant ainsi de larges complexes très stables ayant la particularité de rester solubles.
Ces résultats sont surprenants car contrairement aux sHsp qui possèdent une structure bien définie, les caséines du lait ne possèdent aucun repliement ordonné et existent seulement sous la forme de micelles dans la nature. Leur activité de chaperon moléculaire ne peut donc être due à une propriété conformationnelle. Les auteurs proposent cependant que tout comme pour les sHsp, des interactions hydrophobes avec les substrats en cours d’agrégation sont à l’origine de l’activité chaperon des caséines (Bhattacharyya & Das, 1999). En ce qui concerne les β-caséines, les interactions hydrophobes auraient lieu au niveau de la région N-terminale (Yousefi et al., 2009). Ce mode d’action similaire entre sHsp et caséines est confirmé par une autre étude (Morgan et al., 2005) montrant que l’interaction des caséines avec les protéines dénaturées a lieu avant l’assemblages en larges complexes caséines/substrats.
b. Les protéines solubles du lait
Ce sont les protéines du lactosérum, qui ne précipitent pas par acidification du lait. Elles représentent environ 23% des protéines totales du lait et les principales sont les albumines et les globulines (Jenness, 1988; Recio et al., 1995). Ces protéines solubles ne coagulent pas par voie enzymatique, mais sont déstabilisées et précipitent sous l’action de la chaleur. En effet, un traitement thermique permet de les faire précipiter est ainsi de les récupérer (Mulvihill & Donovan, 1987). En technologie fromagère le lactosérum et donc les protéines solubles sont en grande partie éliminées lors de l’égouttage, en fonction des technologies mises en œuvre. Elles se caractérisent aussi par une forte affinité pour l’eau qui leur confère des propriétés fonctionnelles originales telles qu’un pouvoir hydratant et foisonnant (Jenness, 1988).
La protéine la plus abondante dans le lactosérum est la β-lactoglobuline qui représente environ 60% des protéines du lactosérum, mais seulement 10% des protéines totales du lait de vache, soit environ 8 fois moins que les caséines (Recio et al., 1995). Son rôle reste cependant méconnu mais on suspecte une utilité dans la régulation de l’activité des glandes mammaires, et surtout dans la stimulation des lipases péri gastriques chez les jeunes mammifères afin de faciliter la digestion des lipides du lait (Perez et al., 1992).
La seconde protéine la plus abondante dans le lactosérum est l’α-lactalbumine qui compte pour 13% des protéines du lactosérum mais seulement 2% de protéines totales du lait de vache. Son rôle est primordial et bien connu. Elle est impliquée dans la synthèse du lactose, et plus précisément elle agit sur l’activité de la galactosyl transférase et permet d’accélérer les transferts de galactose sur les glucoses générant ainsi le lactose (Brodbeck et al., 1967).
En plus de ces protéines on peut isoler l’albumine de sérum bovin (BSA) du lactosérum. Cette BSA est la même que celle du sérum sanguin, elle n’est pas synthétisée dans les glandes mammaires mais semble plutôt y diffuser depuis le flux sanguin (Recio et al., 1995). Enfin on retrouve également des immunoglobulines en faibles quantités. Elles ne sont pas produites dans les glandes mammaires mais y sont amenées activement par des transporteurs membranaires spécifiques. Ces immunoglobulines sont importantes et servent en effet à compléter le système immunitaire des jeunes mammifères en attendant qu’ils soient capables de synthétiser ses propres anticorps (Lönnerdal, 1985).
3. Les gels laitiers et le phénomène de coagulation
a. Les différents types de caillés
La coagulation du lait correspond à une déstabilisation de l’état micellaire originel des caséines du lait. Cette déstabilisation peut être réalisée de deux manières :
– soit par voie fermentaire à l’aide de bactéries lactiques contenues dans la flore indigène du lait et/ou apportées sous forme de ferments,
– soit par voie enzymatique à l’aide d’enzymes coagulantes, en particulier la présure. Les mécanismes d’action impliqués lors de la coagulation par voie fermentaire ou enzymatique sont très différents au niveau de la micelle de caséine. Bien qu’ils conduisent tous deux à la formation d’un caillé, les propriétés rhéologiques de ce dernier restent caractéristiques du mode de coagulation.
Dans les techniques fromagères classiques, les deux modes de coagulation ne sont pas utilisés séparément, la coagulation est en fait mixte. Seule varie l’importance relative de la coagulation acide et de la coagulation enzymatique. Les fromages de type pâtes fraîches (fromages blancs, faisselles) et pâtes molles à caractère lactique (Epoisses, Maroilles, Camembert traditionnel) ont une coagulation à caractère mixte mais à large dominante acide, alors que d’autres fromages à pâte molle comme le Pont l’Evêque subissent au contraire une coagulation à dominante enzymatique.
b. La coagulation acide
Le mécanisme de la coagulation par voie fermentaire aussi dite coagulation acide est de nature électrochimique et induit par les ferments lactiques. Les genres Lactobacillus, Lactococcus, Leuconostoc, et Streptococcus sont les plus utilisés tout en variant en fonction des fromages et des technologies. Le Camembert présente par exemple une majorité de Lactococcus, et seuls les laits fermentés par Streptococcus thermophilus et Lactobacillus bulgaricus peuvent prétendre à l’appellation yaourt.
La fonction principale de ces bactéries est de dégrader le lactose pour produire de l’acide lactique. Ce dernier est libéré lors de la croissance des microorganismes et neutralise progressivement les charges électronégatives des caséines κ. La répulsion électrostatique entre les micelles de caséine diminue au fur et à mesure de l’enrichissement du milieu en ions H+, puis disparaît provoquant ainsi un rapprochement et une agrégation des micelles de caséine (Walstra, 1990).
c. La coagulation enzymatique
La coagulation enzymatique du lait est souvent le processus majoritaire de coagulation des fromages à pâte pressée cuite comme le Comté ou le Beaufort. En effet pour ces fromages on ajoute plus d’extraits coagulants que pour les fromages à pâtes molles.
i. L’extrait coagulant
La dénomination « présure » est donnée à l’extrait coagulant provenant de caillettes de jeunes ruminants abattus avant sevrage. De nos jours on l’utilise toujours en technologie fromagère, principalement sous forme liquide ou en poudre.
La présure est constituée en majorité de chymosine, de pepsine et de trypsine en moindre quantité (Berridge, 1952) sécrétées dans le quatrième estomac des ruminants non sevrés. Ces enzymes font partie de la famille des protéinases aspartiques car elles possèdent deux résidus Asp caractéristiques dans leur site actif. Chez l’animal ces protéinases sont sécrétées sous la forme de précurseurs, la prochymosine et le pepsinogène, dans le mucus stomacal avec pour but de digérer le lait maternel (Andren, 1992). Les précurseurs sont appelées zymogènes et possèdent une région N-terminale qui va se loger dans leur site actif, les zymogènes sont ainsi auto-inactivés. Après leur sécrétion, les précurseurs sont activés suite à la perte d’une partie de leur région N terminale. Cette réaction d’activation est effectuée par les conditions acides rencontrées dans l’estomac suite à différents changements conformationnels ainsi que des clivages inter et intra moléculaires (Richter et al., 1998).
La chymosine possède une double activité : une activité spécifique élevée sur le site 105-106 du CMP qui hydrolyse une liaison Phe-Met et qui permet la coagulation du lait et une activité mineure de protéolyse générale sur les différentes fractions caséiniques. La pepsine, quant à elle, est impliquée dans l’hydrolyse d’acides aminés aromatiques comme Phe, Trp et Tyr, et participe également à la protéolyse nécessaire durant la maturation des fromages (Ekaterini, 2011).
La présure joue un rôle important sur les caractéristiques sensorielles des fromages produits. En effet, mis à part la chymosine et la trypsine, la présence de lipases provoque le relargage d’acides gras libres durant la maturation des fromages (Larráyoz et al., 1999). De nombreux fromages tiennent donc leurs caractéristiques uniques du type de présure bien spécifique utilisée lors de leur fabrication. Il existe également des lipases commerciales qui peuvent être ajoutées afin de mieux contrôler les caractéristiques finales des fromages.
L’activité protéolytique de la présure est fortement influencée par les facteurs de milieu. L’activité coagulante sur le lait est réalisée à un pH voisin de 5,5 et la température optimale se situe à 40 à 42° C. En fromagerie classique, les températures du lait au moment de l’emprésurage se situent dans la fourchette 20 à 40° C, et le plus souvent entre 30 et 35° C (Berridge, 1952), la présure a donc presque une activité optimale.
ii. Le mécanisme de coagulation
Le mécanisme de la coagulation enzymatique est décrit en trois phases (Guthy & Novak, 1977; Green & Morant, 1981).
La phase primaire est la phase enzymatique. Le mécanisme d’action des enzymes coagulantes lors de la coagulation du lait est également bien connu (Walstra, 1990). Le caséinomacropeptide, qui constitue un fragment hydrophile et chargé de la caséine κ, est hydrolysé par l’action enzymatique de la présure et est éliminé dans le lactosérum. Le fragment de caséine restant est appelé para caséine κ et possède des propriétés hydrophobes. Dans les premières minutes suivant l’apport de l’enzyme coagulante dans le lait, une diminution de la viscosité du lait apparaît; elle s’explique par la diminution de la dimension moyenne des micelles suite à leur hydrolyse.
La phase secondaire est le début du rapprochement des micelles. Cette phase démarre lorsque environ 85 à 90% des caséines κ sont hydrolysées. La para caséine κ va alors s’agréger aux caséines hydrophobes αS1 et αS2. Les caséines κ formant le manteau hydrophile délimitant les micelles voient alors leur hydrophobicité augmenter. Les micelles de caséine perdent alors leur affinité pour la phase aqueuse et vont se rapprocher et s’agréger entre elles sous l’effet des interactions hydrophobes, faisant ainsi cailler le lait.
Cette phase correspond à la floculation proprement dite. C’est un phénomène dynamique qui se traduit par une modification importante des propriétés physiques du lait. Lorsque l’agrégation des micelles prend le pas sur la réaction d’hydrolyse, la taille des agrégats augmente rapidement et la viscosité s’accroît. Cela conduit à la formation de colloïdes de tailles importantes qui se rejoignent pour former une structure continue appelée le gel laitier.
La phase tertiaire est ce que l’on appelle la phase de réticulation du gel. Celui-ci devient de plus en plus organisé et structuré. Au niveau microscopique, on observe un accroissement des liaisons entre les micelles modifiées, principalement des interactions hydrophobes et électrostatiques, ainsi que la formation des ponts phosphocalciques. Elle correspond au niveau macroscopique au durcissement du gel.
La coagulation enzymatique est un phénomène complexe permis par des forces d’interactions égales à la somme des répulsions électrostatiques et des interactions hydrophobes (Horne, 1998).
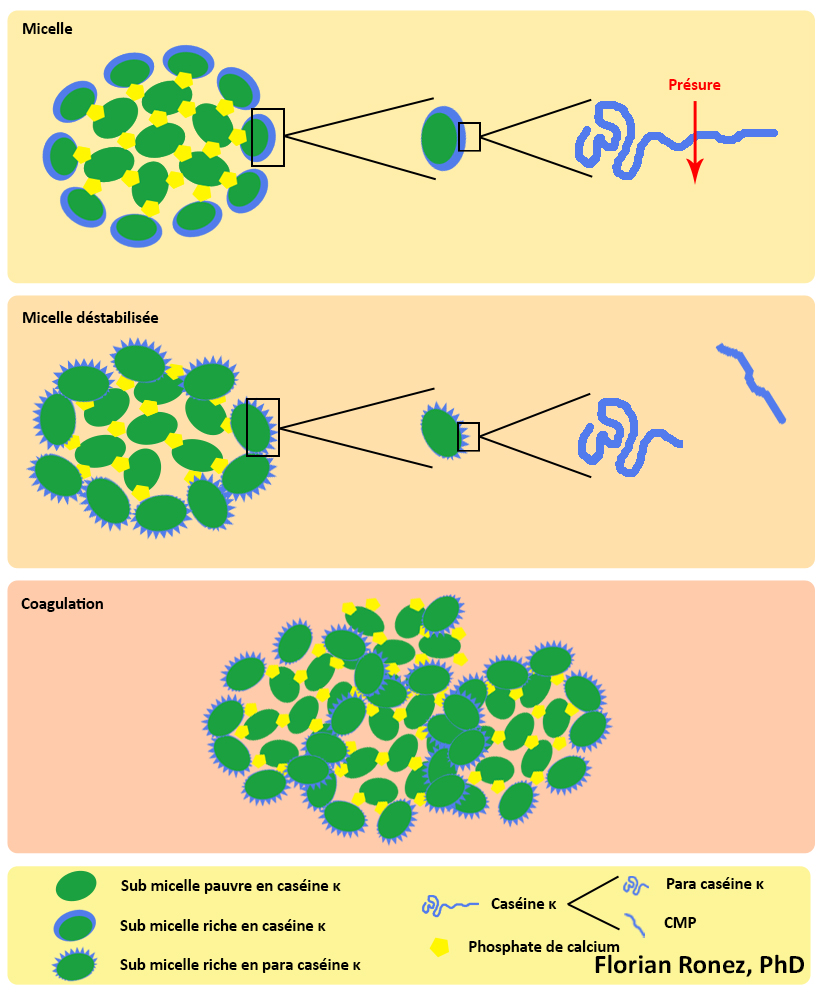
Formation d’un caillé présure par action de la présure sur les caséines du lait (d’après de modèle de Schmidt & Walstra).
Après la prise en gel intervient la phase d’égouttage qui correspond à l’expulsion d’une partie du lactosérum du gel.
4. Mécanisme de synérèse
La prise en gel est donc suivie d’une phase d’égouttage du caillé. Elle est appelée synérèse et correspond à l’expulsion active d’une partie du lactosérum par contraction du gel. La phase active est associée à un processus passif résultant de la perméabilité du coagulum, durant lequel une autre partie du lactosérum s’en échappe (Walstra). L’aptitude d’un gel laitier à la synérèse résulte principalement de la richesse en caséine du lait (Pearse & Mackinlay, 1989).
Le mode de coagulation influence fortement la structure du gel. Les gels obtenus par voie acide présentent des micelles associées en amas et s’égouttent spontanément mais lentement et incomplètement. Au contraire, dans les laits issus de la voie enzymatique, les micelles sont associées en réseau et délimitent des vacuoles qui retiennent le lactosérum ; l’aptitude à l’égouttage spontané de ces gels est par conséquent faible. Il est alors nécessaire d’appliquer des actions physiques comme le tranchage, le brassage et le pressage, ou des traitements physico-chimiques adéquats comme le chauffage. Il est ainsi possible de provoquer une rapide et importante expulsion de lactosérum (Pearse et al., 1986a, 1986b; Pearse & Mackinlay, 1989). Plus les étapes mécaniques comme le tranchage et le brassage des caillés sont importantes, plus l’expulsion initiale de lactosérum des gels est grande. Cela permet donc de s’affranchir dès le départ de la fabrication de problèmes d’humidité trop importante dans les fromages ayant une faible aptitude à la synérèse spontanée.
Enfin, les liaisons inter- et intra-micellaires sont dépendantes des liaisons entre les caséines, elles évoluent donc également au cours de la maturation et de la conservation des produits laitiers.
La mesure de la synérèse est effectuée selon deux approches. La première implique la séparation physique du coagulum et du lactosérum, par exemple par centrifugation (Akkerman et al., 1994; Cayot et al., 2003). Les autres approches consistent à mesurer la dilution progressive d’un marqueur préalablement ajouté.(Pearse et al., 1984). La première approche implique la destruction de l’échantillon mais reste très utilisée de par sa précision et sa facilité de mise en œuvre.
Copyright: Florian Ronez, thèse de doctorat, 2012.
Merci de me citer dans vos sources si vous utilisez mes travaux.
Liste des autres travaux qui pourraient vous intéresser: Cliquez ici

Laisser un commentaire